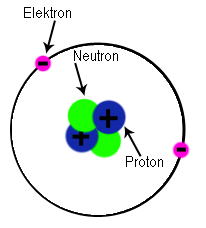
Vad är ett grundämne? Ett
grundämne, som du kanske kommer ihåg av filmen i förra inlägget, är en samling av samma sorts atomer. Kol och syre är två exempel på grundämnen. Kol är uppbyggt av kolatomer och syre av syreatomer.
Hur vet man då vilka atomer som är vilka? Jo, det är antalet
protoner som bestämmer vad det är för grundämne. Kolatomen har 6 protoner i kärnan och syre har 8 protoner.
 |
Här är några exempel på grundämnen. Man brukar färglägga olika grundämnen med olika färger för att se skillnad på dem. För att underlätta så representerar man atomerna i grundämnet som små bollar.
Bild hämtad från:
http://slideplayer.se/slide/1922471/ |
Alla grundämnen är ordnade i något som kallas för
periodiska systemet. Där är olika grundämnen med liknande egenskaper grupperade tillsammans. Det finns 118 olika grundämnen i det periodiska systemet och de är även ordnade efter något som kallas
atomnummer. Varje ämne har ett annat antal protoner, eftersom antalet protoner bestämmer vad det är för grundämne. Ämne nummer 118 har 118 stycken protoner i sin kärna. Vi kommer att prata mer om periodiska systemet längre fram.
 |
Så här ser periodiska systemet ut. Man skriver inte in grundämnets namn utan man använder dess kemiska beteckning istället. Det gör man dels för att det blir lättare att läsa och dels för att alla grundämnen heter olika på olika språk men de har samma kemiska beteckning.
Bild hämtad från:
http://www.ptable.com/?lang=sv |
Vad är då grundämnets atomnummer? Jo, grundämnets
atomnummer talar om hur många protoner som finns i just det grundämnets atomkärnor. Grundämnet väte, som har 1 proton i sin kärna, har atomnummer 1. Vad tror du att grundämnena kol och syre har för atomnummer?
Trots att atomen är så liten så kan man väga en atom. Men det är inte praktiskt att använda kg eller g för att mäta dess vikt så man har hittat på en speciell
atommassenhet u (= unit). Vad är det då som väger i en atom? Jo, det är kärnan med protoner och neutroner. Elektronerna väger nästan ingenting så deras vikt är försumbar (man behöver inte räkna med den). En proton väger 1 u och en neutron väger 1 u.
Atommassan berättar alltså för oss hur mycket atomen väger.
Men varför behöver man veta det? Väger inte alla atomer i ett grundämne lika mycket? Nej, det gör de faktiskt inte. Men vad är det som skiljer i så fall, de har ju lika många protoner? Jo, ett grundämne kan ha
olika antal neutroner. De olika varianterna av grundämnen kallas för
isotoper.
 |
Det här är vätes olika isotoper. Längst till vänster har vi vanligt väte, som saknar neutroner i kärnan. I mitten har vi tungt väte eller deuterium och den har en neutron i kärnan. Längst till höger har vi extra tungt väte eller tritium och den har två neutroner i kärnan och har alltså högst atommassa.
Bild hämtad från:
http://www.human-academy.com/vetenskaper/naturvetenskap/karnfysik.asp |
Alla grundämnen finns runt omkring oss och bygger upp all materia i vår omgivning. Den bygger upp din kropp, träden i naturen, din mobil, skolan, maten vi äter, luften du andas och mycket mer.
Vilka grundämnen är det som finns med i bilden på trädet?